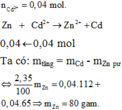1.Cho một bản kẽm vào cốc chứa 200g dd HCl 10%.Khi lấy bản kẽm ra rửa sạch, làm khô cân lại khối lượng giảm đi 6,5g so với trước.Xác định nồng độ dd HCl sau phản ứng.
2.Ngâm 1 lá sắt có khối lượng 5 gam trong 50ml dd CuSO4 15%(d=1.12g/ml). Sau một thời gian lấy lá sắt ra, rửa nhẹ, làm khô cân được 5,16 g. Tính nồng đô % (C%) của chất còn lại trong dd sau phản ứng.